บทนำ: โรคลมชักที่ยังไม่มีคำตอบ
โรคลมชัก (Epilepsy) เป็นโรคทางระบบประสาทที่พบได้บ่อย ส่งผลกระทบต่อประชากรประมาณ 0.5-1% ทั่วโลก ผู้ป่วยต้องเผชิญกับอาการชักซ้ำๆ ซึ่งเกิดจากการทำงานผิดปกติของเซลล์ประสาทในสมอง แม้ว่าปัจจุบันจะมียาต้านชักหลายรุ่นให้เลือกใช้ แต่ผู้ป่วยจำนวนมากถึง 15-35% ยังคงควบคุมอาการชักไม่ได้อย่างสมบูรณ์1,2 ความจริงข้อนี้ชี้ให้เห็นว่าเรายังต้องการยาตัวใหม่ๆ ที่มีกลไกการทำงานแตกต่างจากเดิม
หัวใจสำคัญของโรคลมชักอยู่ที่ความไม่สมดุลระหว่างสัญญาณกระตุ้นและสัญญาณยับยั้งในสมอง นักวิจัยจึงมุ่งเน้นไปที่การค้นหาเป้าหมายใหม่ในการพัฒนายา และหนึ่งในเป้าหมายที่น่าสนใจที่สุดคือ ตัวรับกรดกลูตาเมตชนิด AMPA (AMPA receptors) ซึ่งมีบทบาทสำคัญในการส่งสัญญาณกระตุ้นอย่างรวดเร็วในสมอง1,3
กรดกลูตาเมตและตัวรับ AMPA: ผู้เล่นหลักในละครสมอง
กรดกลูตาเมต (Glutamate) เป็นสารสื่อประสาทกระตุ้นที่สำคัญที่สุดในระบบประสาทส่วนกลาง มีหน้าที่ส่งสัญญาณระหว่างเซลล์ประสาท และมีบทบาทสำคัญในการเรียนรู้และความจำ2 เมื่อกรดกลูตาเมตถูกปล่อยออกมาจากเซลล์ประสาท มันจะไปจับกับตัวรับหลายชนิดบนเซลล์ประสาทเป้าหมาย ตัวรับเหล่านี้แบ่งออกเป็น 2 กลุ่มใหญ่คือ:
- Ionotropic receptors (ตัวรับที่เป็นช่องไอออน) ประกอบด้วย NMDA, AMPA และ kainate receptors
- Metabotropic receptors (ตัวรับที่ทำงานผ่าน G-protein)
ในบรรดาตัวรับเหล่านี้ ตัวรับ AMPA ถือเป็นผู้เล่นหลักที่รับผิดชอบการส่งสัญญาณกระตุ้นอย่างรวดเร็ว1,2 เมื่อกรดกลูตาเมตมาจับกับตัวรับ AMPA ช่องไอออนจะเปิดขึ้น ทำให้ไอออนโซเดียมไหลเข้าสู่เซลล์ ส่งผลให้เกิดการกระตุ้นเซลล์ประสาทอย่างรวดเร็ว2
ที่น่าสนใจคือ ตัวรับ AMPA มีโครงสร้างที่ซับซ้อน ประกอบด้วยหน่วยย่อย (subunits) 4 ชิ้นที่เรียกว่า GluA1, GluA2, GluA3 และ GluA41,2 การจัดเรียงตัวของหน่วยย่อยเหล่านี้จะกำหนดคุณสมบัติของตัวรับ โดยเฉพาะการซึมผ่านของแคลเซียม ซึ่งมีความสำคัญต่อการเปลี่ยนแปลงระยะยาวของจุดเชื่อมประสาท (synaptic plasticity) และการเกิด epileptogenesis2
เมื่อตัวรับ AMPA กลายเป็นตัวร้ายในโรคลมชัก
งานวิจัยหลายชิ้นชี้ให้เห็นว่าตัวรับ AMPA มีบทบาทสำคัญในการเกิดและการดำเนินของโรคลมชัก หลักฐานหนึ่งมาจากกรณีของ กรดโดโมอิก (domoic acid) ซึ่งเป็นสารพิษจากทะเลที่กระตุ้นตัวรับ AMPA และ kainate ในมนุษย์ การได้รับสารนี้มากเกินไปทำให้เกิดอาการชัก และอาจนำไปสู่โรคลมชักชนิด temporal lobe epilepsy ในภายหลัง1,3
นอกจากนี้ การศึกษาในเนื้อเยื่อสมองจากผู้ป่วยโรคลมชักพบว่า เมื่อปิดกั้นการทำงานของตัวรับ AMPA จะสามารถยับยั้งการเกิดคลื่นไฟฟ้าผิดปกติแบบ interictal-like ได้ แต่การปิดกั้นตัวรับ NMDA กลับไม่มีผล1 นี่แสดงให้เห็นว่าตัวรับ AMPA มีบทบาทสำคัญในการเกิดกิจกรรมไฟฟ้าผิดปกติในสมองของผู้ป่วยลมชัก
ที่น่าสนใจยิ่งขึ้นคือ ในสมองของผู้ป่วยลมชักพบว่ามีการเพิ่มขึ้นของหน่วยย่อย GluA1 โดยเฉพาะในบริเวณฮิปโปแคมปัส1 การเพิ่มขึ้นนี้บ่งชี้ว่ามีตัวรับ AMPA ที่ขาดหน่วยย่อย GluA2 มากขึ้น ซึ่งทำให้ตัวรับมีการซึมผ่านของแคลเซียมสูง และอาจเป็นส่วนหนึ่งของกระบวนการที่นำไปสู่ความเสื่อมของเซลล์ประสาทและการพัฒนาของโรคลมชัก1,2
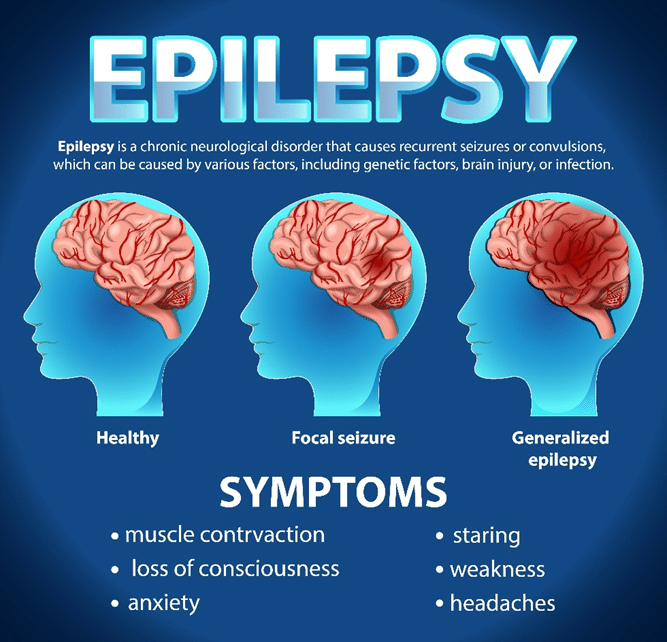
พลังของยาต้านตัวรับ AMPA: หลักฐานจากการทดลอง
เมื่อเข้าใจบทบาทของตัวรับ AMPA แล้ว คำถามต่อมาคือ การปิดกั้นตัวรับ AMPA จะช่วยป้องกันการชักได้จริงหรือไม่? คำตอบจากการทดลองในสัตว์นั้นชัดเจนมาก
ยาต้านตัวรับ AMPA ทั้งแบบ competitive (แย่งจับที่เดียวกับกรดกลูตาเมต) และ non-competitive (จับที่ตำแหน่งอื่น) ต่างก็แสดงผลต้านการชักได้ดีในแบบจำลองสัตว์ทดลองหลายชนิด1,3 ตัวอย่างเช่น:
- แบบจำลอง maximal electroshock (จำลองอาการชักแบบ tonic-clonic)
- แบบจำลอง pentylenetetrazole (จำลองอาการชักแบบ myoclonic)
- แบบจำลอง amygdala-kindling (จำลองอาการชักแบบ partial-onset)
- แบบจำลอง 6 Hz psychomotor seizure
ที่น่าสนใจคือ ยาต้านตัวรับ AMPA ยังคงประสิทธิผลแม้เมื่อเพิ่มความเข้มของสิ่งกระตุ้นให้สูงขึ้น ในขณะที่ยาอื่นๆ อาจลดประสิทธิผลลง1,3
นอกจากนี้ ยาต้านตัวรับ AMPA ยังแสดงผลดีในสถานการณ์ status epilepticus (SE) ซึ่งเป็นภาวะฉุกเฉินที่การชักยาวนานและไม่หยุด การศึกษาพบว่าหลังจาก SE เริ่มต้นไประยะหนึ่ง ตัวรับ GABA จะถูกนำเข้าสู่เซลล์ ทำให้ยากลุ่ม benzodiazepines ที่กระทำกับ GABA มีประสิทธิผลลดลง แต่การส่งสัญญาณผ่านตัวรับ AMPA ยังคงอยู่2,3 ดังนั้น ยาต้านตัวรับ AMPA จึงมีศักยภาพในการรักษา SE โดยเฉพาะในกรณีที่ดื้อต่อยามาตรฐาน2,3
ความท้าทายในการพัฒนายา: เมื่อประสิทธิผลมาพร้อมผลข้างเคียง
แม้ว่าผลการทดลองในสัตว์จะดูน่าหวัง แต่การนำยาต้านตัวรับ AMPA มาใช้ในมนุษย์กลับเจออุปสรรคใหญ่ เนื่องจากตัวรับ AMPA มีบทบาทสำคัญในการส่งสัญญาณกระตุ้นปกติทั่วสมอง การยับยั้งตัวรับนี้จึงมักก่อให้เกิดผลข้างเคียงทางระบบประสาทส่วนกลาง เช่น ง่วงซึม เดินเซ วิงเวียน3
ยาต้านตัวรับ AMPA รุ่นแรกๆ มักมี therapeutic index (ระยะห่างระหว่างขนาดที่ได้ผลกับขนาดที่เป็นพิษ) ที่แคบมาก3 นี่หมายความว่า ขนาดยาที่ช่วยลดการชักนั้นใกล้เคียงกับขนาดที่ทำให้เกิดผลข้างเคียงมาก ทำให้ยากต่อการใช้ในผู้ป่วยโรคเรื้อรังอย่างโรคลมชัก
นอกจากนี้ ยาต้านตัวรับ AMPA แบบ competitive (orthosteric antagonists) มักมีปัญหาเรื่องการซึมผ่านเข้าสมองต่ำ อาจทำให้เกิดผลข้างเคียงส่วนปลายได้3 ในทางตรงกันข้าม ยาแบบ non-competitive (negative allosteric modulators) กลุ่ม 2,3-benzodiazepine มักมีการซึมผ่านเข้าสมองดีกว่า แม้จะมีฤทธิ์อ่อนกว่า3
บริษัทยาหลายแห่งจึงหันไปพัฒนายาต้านตัวรับ AMPA สำหรับโรคเฉียบพลัน โดยเฉพาะโรคหลอดเลือดสมอง แต่การทดลองทางคลินิกก็ล้มเหลว เพราะพบผลข้างเคียงที่รุนแรงเกินไป3
ความสำเร็จที่ยากจะเกิดขึ้น: การพัฒนายาต้านตัวรับ AMPA ที่ใช้ได้จริง
แม้จะมีอุปสรรคมากมาย แต่การวิจัยก็ไม่หยุดนิ่ง นักวิทยาศาสตร์พยายามหาวิธีเอาชนะปัญหาผลข้างเคียงโดยใช้แนวคิด drug discovery แบบดั้งเดิมแต่ประยุกต์ให้ดีขึ้น มียา 2 ตัวที่โดดเด่นและเข้าสู่การทดลองทางคลินิก คือ talampanel และ perampanel
Talampanel: ผู้บุกเบิกที่ไม่สำเร็จ
Talampanel เป็นยาต้านตัวรับ AMPA แบบ non-competitive ชนิดแรกที่เข้าสู่การทดลองทางคลินิกในโรคเรื้อรัง รวมถึงโรคลมชัก โรค ALS และมะเร็งสมอง3 ในการทดลอง Phase II กับผู้ป่วยลมชักดื้อยา talampanel สามารถลดความถี่การชักได้ โดยมีค่ามัธยฐานของการลดลงที่ 21%3
แม้จะมีผลดี แต่ talampanel มีข้อจำกัดสำคัญคือมี half-life สั้น และต้องรับประทานหลายครั้งต่อวัน3 นอกจากนี้ ยังมีปัญหาเรื่อง metabolism ที่ซับซ้อน ทำให้ระดับยาในเลือดขึ้นลงมาก อาจส่งผลต่อความปลอดภัย ท้ายที่สุดยานี้จึงไม่ได้ออกสู่ตลาด3
Perampanel: ความหวังใหม่ที่กลายเป็นจริง
Perampanel เป็นยาต้านตัวรับ AMPA แบบ non-competitive ที่มีโครงสร้างแกนกลางเป็น 1,3,5-triaryl-1H-pyridin-2-one ค้นพบจากการ high-throughput screening ร่วมกับการวิเคราะห์ความสัมพันธ์ระหว่างโครงสร้างและฤทธิ์3
จุดเด่นของ perampanel อยู่ที่ half-life ที่ยาวนาน (66-90 ชั่วโมง หลังรับประทานหลายครั้ง) ทำให้ระดับยาในเลือดค่อยๆ เพิ่มขึ้นอย่างสม่ำเสมอก่อนถึงระดับคงที่3 ลักษณะทางเภสัชจลนศาสตร์แบบนี้ช่วยให้ผู้ป่วยพัฒนาความทนทานต่อผลข้างเคียงได้ดีขึ้น การออกแบบการทดลองทางคลินิกของ perampanel ก็ชาญฉลาดมาก ได้แก่:
- ปรับขนาดยาอย่างค่อยเป็นค่อยไป เพื่อให้ร่างกายปรับตัว
- รับประทานก่อนนอน เพื่อให้ระดับยาสูงสุดเกิดขึ้นขณะหลับ ลดโอกาสเกิดผลข้างเคียงในเวลากลางวัน[3]
บทเรียนและอนาคต: ต่อยอดจากความสำเร็จ
ความสำเร็จของ perampanel แสดงให้เห็นว่า แม้เป้าหมายทางยาจะมีความท้าทาย แต่ก็สามารถพัฒนายาที่ใช้ได้จริงด้วยการออกแบบโมเลกุลที่ดี และการวางแผนการทดลองทางคลินิกที่ชาญฉลาด3
สำหรับอนาคต นักวิจัยกำลังสำรวจบทบาทของตัวรับ AMPA ใน epileptogenesis (กระบวนการพัฒนาของโรคลมชัก) โดยเฉพาะในสมองทารกและเด็ก งานวิจัยแสดงให้เห็นว่า การเปลี่ยนแปลงของตัวรับ AMPA หลังจากอาการชักในระยะทารกอาจส่งผลต่อความไวต่อการชักในอนาคต รวมทั้งความบกพร่องทางสติปัญญาและพฤติกรรม2,3
นอกจากนี้ การศึกษายังเปิดทางไปสู่การพัฒนายาชนิดใหม่ที่อาจ:
- กระทำกับ auxiliary subunits เพื่อเลือกกระทำเฉพาะบริเวณสมอง
- เป็น use-dependent หรือ voltage-dependent blockers เพื่อลดผลข้างเคียง
- กระทำกับ positive allosteric modulators สำหรับโรคอื่นๆ ที่ต้องการเพิ่มการทำงานของตัวรับ AMPA3
สำหรับการรักษา status epilepticus การศึกษาในสัตว์แสดงให้เห็นว่ายาต้านตัวรับ AMPA มี therapeutic window ที่กว้างกว่ายากลุ่ม benzodiazepines2,3 แม้ว่ายังไม่มีการทดลองทางคลินิกขนาดใหญ่ แต่ก็เป็นทิศทางที่น่าสนใจสำหรับการวิจัยต่อไป
สรุป: จากวิทยาศาสตร์พื้นฐานสู่การรักษาผู้ป่วย
เส้นทางจากการค้นพบบทบาทของตัวรับ AMPA จนถึงการพัฒนายาที่ใช้ได้จริงเป็นตัวอย่างที่ดีของการแปลงงานวิจัยพื้นฐานสู่การรักษา (translational research) แม้ว่าจะใช้เวลานานกว่าสองทศวรรษ แต่ในที่สุดก็ประสบความสำเร็จ นำมาซึ่งทางเลือกการรักษาใหม่ให้กับผู้ป่วยโรคลมชักหลายแสนคนทั่วโลก
ยาต้านตัวรับ AMPA ไม่เพียงแต่เปิดประตูสู่กลไกการทำงานใหม่ในการรักษาโรคลมชัก แต่ยังให้ความหวังว่าในอนาคตอาจมียาที่สามารถป้องกันการเกิดโรคลมชักได้ หรือชะลอการดำเนินของโรคในผู้ป่วยที่มีโรคลมชักแบบลุกลาม2,3
การวิจัยในด้านนี้ยังคงดำเนินต่อไป โดยมีเป้าหมายเพื่อ:
- เข้าใจบทบาทของตัวรับ AMPA ในกระบวนการ epileptogenesis ให้ดียิ่งขึ้น
- พัฒนายาที่มีความจำเพาะเจาะจงและปลอดภัยมากขึ้น
- ขยายการใช้งานไปยังอาการชักชนิดอื่นๆ และโรคทางระบบประสาทอื่นๆ
ท้ายที่สุด ความก้าวหน้าในการพัฒนายาต้านตัวรับ AMPA สะท้อนให้เห็นว่า ความเข้าใจที่ลึกซึ้งในวิทยาศาสตร์พื้นฐาน ความมุ่งมั่นในการวิจัย และการออกแบบยาที่ชาญฉลาด สามารถนำไปสู่การรักษาใหม่ที่เปลี่ยนแปลงชีวิตผู้ป่วยได้จริง